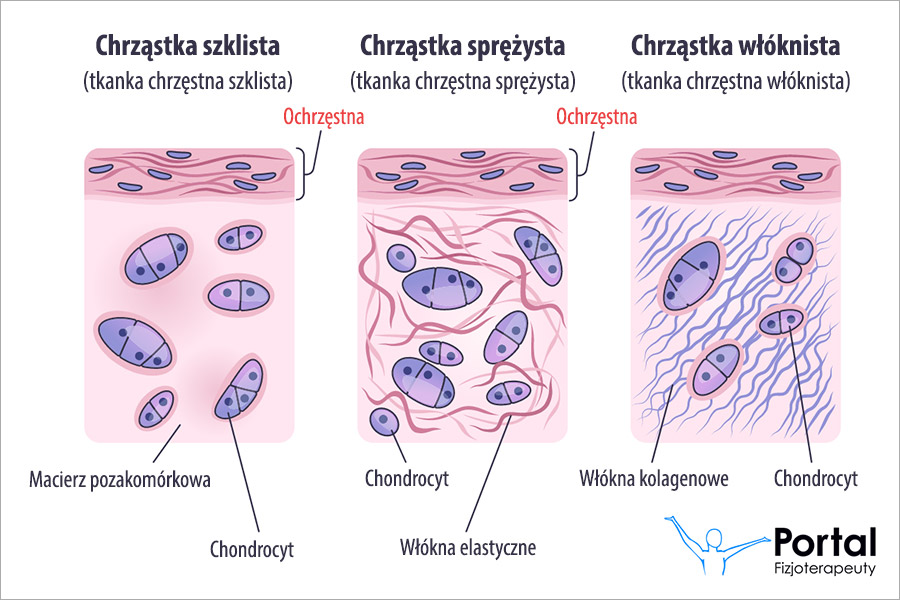
Hemoglobina (Hb) stanowi czerwony barwnik krwi. To białko zlokalizowane w erytrocytach, które jest niezbędne do życia. Pełni bowiem jedną z najważniejszych funkcji organizmu jaką jest transport tlenu.

Synteza hemoglobiny
Synteza omawianego związku zachodzi w szpiku kostnym. Odpowiedzialne są za to komórki potomne proerytroblastu, a także erytroblasty zasadochłonne i polichromatofilne.
Jak zbudowana jest hemoglobina?
Jedna jej cząsteczka składa się z białka o nazwie globina. Ten z kolei zbudowany jest z 4 łańcuchów polipeptydowych i 4 cząsteczek hemu. Każda z cząsteczek hemu łączy się z 1 łańcuchem polipeptydowym.
Wyróżnia się 3 rodzaje tego czerwonego barwnika. U dorosłych osób aż 97% stanowi hemoglobina A1, z kolei 2,5% hemoglobina A2. Najmniej, ponieważ około 0,5% stanowi hemoglobina płodowa oznaczana dużą literą F.
Budowa poszczególnych rodzajów hemoglobiny różni się głównie typami łańcuchów. W związku z tym hemoglobina A1 składa się z 2 łańcuchów polipeptydowych typu alfa i 2 typu beta, zaś hemoglobina A2 z 2 łańcuchów typu alfa i 2 typu delta. Natomiast hemoglibona płodowa zbudowana jest z 2 łańcuchów alfa i 2 gamma.
Największa ilość hemoglobiny płodowej przypada (jak wskazuje nazwa) na okres prenatalny. Tuż po urodzeniu jej zawartość stopniowo maleje, aby w 6 miesiącu życia dziecka ustalić się na poziomie 0,5%.
Czym jest oksyhemoglobina?
Oksyhemoglobina to cząsteczka hemoglobiny zawierająca 4 atomy żelaza dwuwartościowego powiązana z 4 cząsteczkami tlenu. Innymi słowy jest to hemoglobina związana z tlenem. Stopień wysycenia hemoglobiny tlenem, czyli równowaga między wiązaniem hemoglobiny z tlenem i uwalnianiem tlenu z oksyhemoglobiny zależy od:
- prężności tlenu;
- temperatury krwi;
- prężności dwutlenku węgla;
- stężenia jonów wodoru, czyli pH.
Wraz ze zwiększaniem prężności tlenu we krwi zwiększa się wysycenie hemoglobiny tlenem. Przykładowo, przy prężności tlenu we krwi na poziomie 12,7 kPa już 97,5% hemoglobiny jest całkowicie wysycone tlenem. Ciśnienie parcjalne tlenu w powietrzu wdychanym wynosi 21,1 kPa
Wiązanie hemoglobiny z tlenem zwiększa się znacznie w momencie spadku temperatury krwi. Jednakże musi zostać zachowana ta sama prężność tlenu. Z kolei zwiększenie prężności dwutlenku węgla we krwi zmniejsza stopień wysycenia hemoglobiny tlenem. Tak samo działa również zwiększenie stężenia wolnych jonów wodoru we krwi.
Oksyhemoglobina jest formą stosunkowo bardzo stabilną, jednak pod wpływem czynników utleniających może przekształcać się w methemoglobinę. Szacuje się, że zjawisko to następuje u około 3% całkowitej ilości hemoglobiny każdego dnia. Przyczynia się to do powstawania wolnych rodników tlenowych negatywnie wpływających na zdrowie i wygląd. Dlatego warto sięgać po produkty przeciwutleniające, które maksymalnie zminimalizują ten proces (popularne antyoksydanty, np. witamina C czy witamina E).
Inne rodzaje hemoglobiny
W fizjologii wyróżnia się także:
- methemoglobinę – w której pod wpływem związków utleniających dwuwartościowy atom żelaza zamienia się na atom trójwartościowy. Taka hemoglobina nie posiada zdolności transportu tlenu;
- karboksyhemoglobinę – w której tlen został wyparty przez tlenek węgla, ponieważ ma aż 200 razy większe powinowactwo do hemoglobiny niż cząsteczka tlenu.
Funkcje hemoglobiny
Główną funkcją hemoglobiny jest jej udział w transporcie tlenu z płuc do wszystkich tkanek organizmu. W niewielkim stopniu transportuje ona również dwutlenek węgla z tkanek do płuc. Zarówno hemoglobina, jak i mioglobina związane z tlenem są ważnym magazynem tlenu w organizmie człowieka. Zaspokaja on zapotrzebowanie na tlen, jednak tylko na kilka minut.
Poza swoją podstawową funkcją hemoglobina może działać jako czynnik pseudoenzymatyczny. Oznacza to, że choć nie jest białkiem enzymatycznym, to w niektórych przypadkach może wykazywać aktywność katalazy. Dodatkowo hemoglobina posiada także aktywność peroksydazową. W efekcie może utleniać np. dopaminę.
Polecane produkty:

|
Spirulina + Żelazo - wsparcie dla hemoglobiny
Spirulina + Żelazo od bioalgi jest 100% naturalnym, roślinnym źródłem żelaza. Jest bardzo dobrze przyswajalne przez organizm człowieka, dzięki czemu uzupełnia niedobory żelaza, ale również innych, ważnych składników odżywczych niezbędnych do prawidłowego Zobacz więcej... |
Bibliografia
- Traczyk W., Fizjologia człowieka w zarysie, Wydawnictwo Lekarskie PZWL, Warszawa 2007.
- Zapora E., Jarocka I., Hemoglobina – źródłem reaktywnych form tlenu, Postępy Higieny i Medycyny Doświadczalnej, 67/2013.