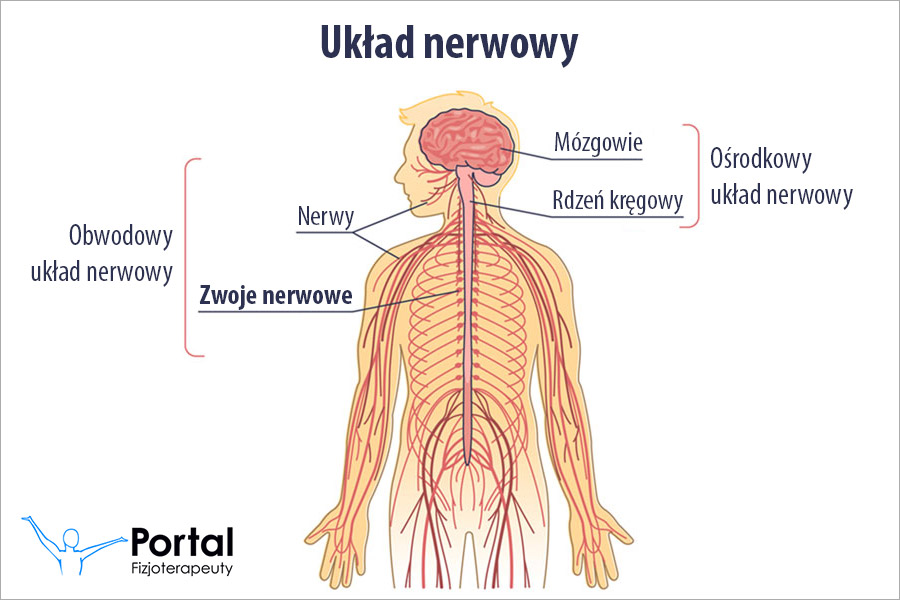
Hydroliza to zazwyczaj odwracalna reakcja podwójnej wymiany. Zachodzi pod wpływem wody między wodą a substancją w niej rozpuszczoną. Prowadzi do powstania nowych cząsteczek chemicznych, które jednak pod wpływem odpowiednich czynników można zmienić.
Co ulega hydrolizie?
Nie wszystkie substancje ulegają hydrolizie – przykładem mogą być cukry proste, które nie poddają się reakcjom chemicznych w obecności wody. Hydrolizować mogą między innymi następujące substancje:
- polisacharydy;
- sole kwasów i zasad;
- chlorobenzen;
- estry.
Szczególną uwagę zwraca się na hydrolizę soli. Hydrolizować mogą sole:
- słabych kwasów i mocnych zasad;
- mocnych kwasów i słabych zasad;
- słabych kwasów i słabych zasad.
Hydroliza często przebiega w obecności katalizatorów.
Hydroliza – przebieg
Przebieg hydrolizy można zapisać w ułatwieniu stosując skróty. Przykładowo: AB + HOH -> AH + BOH, gdzie AB stanowi substancję ulegającą hydrolizie, zaś AH oraz BOH to produkty końcowe reakcji.
Jak wcześniej wspomniano, niektóre czynniki zwiększają szybkość omawianego procesu. Są to tak zwane katalizatory, czyli najczęściej kwasy lub zasady. Niekiedy tempo hydrolizy może wzrosnąć po podgrzaniu, czyli w środowisku o wyższej temperaturze. Dzieje się tak np. przy hydrolizowaniu bezwodnika octowego.
Hydroliza – zastosowanie
Hydroliza jest jedną z najbardziej podstawowych reakcji chemicznych. Znalazła zastosowanie w wielu dziedzinach przemysłu, w tym w gastronomii, gdzie hydrolizuje się wielocząsteczkowe związki. Przykładem takich związków mogą być wielocukry i białka, dzięki czemu można uzyskać pożądane syropy, miody sztuczne czy produkty fermentacji. Hydrolizę można również zauważyć przy dojrzewaniu niektórych serów. Pojęcie hydrolizy często przewija się w tematyce związanej z drewnem (hydroliza drewna, scukrzanie drewna).
Rodzaje hydrolizy
W chemii podstawowy podział hydrolizy obejmuje hydrolizę:
- kationową;
- anionową;
- kationowo-anionową.
Hydroliza kationowa ma miejsce wówczas, gdy reakcji ulegają kationy. Wówczas nadmiar jonów + powoduje kwasowy odczyn powstałego roztworu. Podsumowując, sole pochodzące od mocnych kwasów i słabych zasad hydrolizują z odczynem kwasowym.
Inaczej sytuacja wygląda przy hydrolizie anionowej, podczas której reakcji ulegają aniony. Wówczas efektem będzie zasadowy odczyn powstałego roztworu, na co wpływa nadmiar jonów OH-. Podsumowując, sole słabych kwasów i mocnych zasad hydrolizują z odczynem zasadowym.
Z kolei hydroliza kationowo-anionowa ma miejsce wówczas, gdy reakcji ulegają zarówno kationy, jak i aniony. W efekcie takich reakcji odczyn powstałego roztworu będzie obojętny, ponieważ moc powstałych produktów będzie do siebie zbliżona. Podsumowując, sole słabych kwasów i słabych zasad hydrolizują z odczynem obojętnym.
Polecane produkty:

|
Wałek igłowy – aplikator wieloigłowy
Wałek igłowy to aplikator przeznaczony do wykonywania masażu na różne części ciała. Wysoka efektywność znalazła zastosowanie w kompleksowej terapii różnych schorzeń, a także profilaktyce ... Zobacz więcej... |
Bibliografia
- Jones L., Atkins W., Chemia ogólna. Cząsteczki, materia, reakcje, Wydawnictwo Naukowe PWN, 2018.